2017年1月
オーラルフレイル
「オーラルフレイル」というタームが最近、よく聞かれる。これは、東京大学高齢社会総合研究機構 准教授であり、内閣府「一億総活躍国民会議」有識者民間議員である飯島勝也氏が、提唱した言葉だ。超高齢化社会を迎えて、地域包括ケアシステムの構築と同時に、このタームを作り出すことによって、社会に”フレイル”の予防を訴えている。ご本人の説明では、「フレイル」は「虚弱」を意味する"frailty"を形容詞化した造語で、虚弱の予防を社会にアピールするために、この言葉を普及させたい意図があった、とのことだ。だから、「オーラルフレイル」とは、口腔機能の低下のことで、具体的には、滑舌の低下、たべこぼし、わずかなむせ、咬めない食品の増加、などを指す(1)。
なぜ、今、「オーラルフレイル」かというと、国民健康運動の核となるタームが必要だからだ。2007年に超高齢社会を迎えた日本では、2025年に団塊の世代が75歳以上となり、要介護高齢者が急増することが予想されるている。平成25年度から開始された「21世紀に おける国民健康づくり運動(健康日本21(第2次))」において、健康寿命の延伸と健康格差の縮小、 生活習慣病の発症予防と重症化予防の徹底(NCD(非感染性疾患)の 予防) 、社会生活を営むために必要な機能の維持及び向上 、健康を支え、守るための社会環境の整備 、栄養・食生活、身体活動・運動、休養、飲酒、喫煙及び歯・口腔の健康に関する生活習慣及び社会環境の改善、が国民の健康の増進の推進に関する基本的な方向として示された。これは、いわば国家戦略として、国民の健康寿命延伸が取り上げられたわけだ。そして、これに対応して、2015年に日本歯科医師会は「健康寿命延伸のための歯科医療・口腔保健 世界会議2015」を開催したが、「オーラルフレイル」という言葉はこの会議において紹介された。
口腔機能の虚弱化は全身の虚弱化の反映であるが、逆に口腔機能の維持が全身健康の維持にもつながるわけで、その意味で歯科医師会は、従来の齲蝕や歯周病だけでなく、口腔機能の管理や栄養支援がこれからの歯科の役割と捉えているわけだ。
日本歯科医師会の向かう方向はよし、だ。
参考文献:
(1)オーラルフレイル、われわれは何をすべきか?the Quintessemce. Vol.36 NO.1.56-65.2017.
(2)日本歯科医師会HP:http://www.jda.or.jp/enlightenment/oral/index.html
サルコペニアの発症メカニズム
上記以外の分子レベルのサルコペニアの発症モデルとして、ミトコンドリア機能との関係が注目されている。骨格筋ミトコンドリアの機能の一つに、筋の質的・量的調節があるのだが、サルコペニアでは骨格筋ミトコンドリアの機能低下により、筋肉が減少する可能性が示唆された。最近の基礎的研究で、降圧薬であるアンジオテンシンⅡ受容体阻害薬をラットに投与し続けると、骨格筋の脂肪酸β酸化を増大させ、さらに骨格筋が増量する事実が報告されている(2)。特に、PPARγ(ピーピーエイアールガンマ、Peroxisome Proliferator-Activated Receptor γ:核内受容体スーパーファミリーに属する蛋白。遺伝子の転写の調節をする。リガンドの特異性は低く、多くのリガンドと結合する。アンギオテンシンⅡ受容体拮抗薬の一部のものもPPARγのリガンド。)作用性ARB(SPPARM)(ARBとはアンギオテンシンⅡ受容体拮抗薬のこと)を長期間投与すると前記の効果が得られるという。本来、アンギオテンシンⅡ受容体阻害薬は血圧を下げるための薬剤だが、その核内受容体PPARγは血管内皮細胞以外にも,脂肪組織をはじめ、骨格筋を含めて多くの組織に存在するため、血圧調節以外にも骨格筋の増量などの効果が発現するのだろう。
AMPキナーゼと老化
昨日書いたように、骨格筋内のエネルギー、すなわちATPが不足するとAMPキナーゼ(AMPK)が活性化され、GLUT4の転写及び翻訳をともに亢進し、その結果、インスリン刺激によるグルコースの取り込みを上昇させる。さて、このこAMPキナーゼは、低グルコースや低酸素状態、虚血、あるいは熱ショックなど、細胞のATPを枯渇させるようなストレスに応答して活性化される。また、数々の研究から、アディポネクチン (Adiponectin)、レプチン (Leptin)、及びカルモジュリンキナーゼキナーゼβ (CaMKKβ) を介したシグナル伝達もまた、AMPKの活性化にとって重要であることが示されている。
AMPKはまた、脂肪酸酸化や解糖系のような分解系を刺激してATP産生を増加させる。さらに、AMPKは、グリコーゲン合成酵素などの細胞内のATP消費に関連する数々のタンパク質をマイナスに調節することでATPの消費を制限している。その結果、糖新生、及びグリコーゲン、脂質及びタンパク質の生合成を低下させたり阻害したりする働きもする。脂質とグルコース両方の代謝に中心的な調節因子としての役割を果たすため、AMPKは肥満やII型糖尿病、そしてがんの治療にとって鍵となる標的であると考えられているのだ。興味深いことに、AMPKは、今日、mTOR、SirT1(サーチュイン)及びセストリンとの相互作用を通じて、老化の決定的な調節因子としても認識されている。
その活性化により、骨格筋細胞内へのグルコース取り込みに関与するAMPキナーゼは、老化の調節にも関連しているらしい情報もあり、要注目の酵素だろう。当面、自分的には、筋肉を鍛錬することで、この酵素にしっかり活躍してもらいたいものだ。
なぜ一定量の筋肉は必要なのか?
別にマッチョになろうとは思っていないが、トレーニングして筋肉を一定量、維持することは重要だと認識している。筋肉の量が次第に減ることは、老化していることに他ならないからだ。老化は衰弱だ。エネルギーの低下だ。活動性の減弱だ。まだまだ、私はやり残していることが多くあるので、体力と気力が必要だ。衰弱などしておれないのだ。よって老化を忌み嫌う。
で、なぜ筋肉の量が減ることは、全身の衰弱と結びつくのだろうか?今日のテーマはそこのところだ。
その鍵はミトコンドリアにある。ミトコンドリアは全身の細胞内に存在する小器官だが、実は骨格筋の中にはミトコンドリアが豊富に存在する。このミトコンドリアは、実に多くのうれしい機能を担っているのをご存じだろうか。その一つは、ミトコンドリアは脂肪酸β酸化によりエネルギーを産生している。エネルギーとはATPだ。ミトコンドリアがATPを作り出すのだ。そして筋肉にはミトコンドリアが豊富に存在する。だから、筋肉量が多ければ、生み出せるATPの量も多い=活動量が高い=若々しく生きる、という図式が成立する。したがって、一定の活動量を維持するには、骨格筋の量も一定量維持される必要があるわけだ。基礎代謝における骨格筋の熱消費量は全身の30%と言われており、人体のエネルギー消費のもっとも盛んな器官である。と、同時に、最大のエネルギー産生器官でもある。
また、骨格筋は、当然のことだが、運動するのに必要なものだ。ところで、運動は健康に良いと一般的にいわれているが、具体的な運動の健康面に及ぼすプラスの効果の一つは、抗糖尿病作用だ。運動は糖尿病を改善し、予防するのだ。糖尿病になるとインスリンの糖取り込み作用が低下する。この糖取り込み低下は、骨格筋に起因することが明らかになっている。運動はこの骨格筋の糖取り込みを増加させ、インスリン抵抗性を改善する。このメカニズムとして、骨格筋内のエネルギ―状態を感知するAMPキナーゼの活性化が想定されている。この刺激により、GLUT4(グルコーストランスポーター4)が細胞内の貯蔵場所から細胞膜に移動し、グルコースの運搬を始める、と考えられている。つまり、生体内の唯一の血糖降下ホルモンであるインスリンとは異なる情報伝達経路により、血糖値を低下させうるのだ。やはりそうか。血糖値を上げるホルモンは多く存在するのに下げるホルモンはインスリンしかない、というのはどう考えても理不尽だと、以前から思っていた。
糖尿病は骨格筋のインスリン情報伝達の不全により、糖取り込みが阻害されて起こる。その一方で、インスリンに頼らず血糖値を下げるもう一つのメカニズムが存在している。それが運動だ。筋トレだ。筋肉を鍛錬することで、糖尿病は改善する。だから、一定量の筋肉は必要なのだ。
参考文献:亀井康富、小川佳宏.骨格筋からみた糖尿病の病態と治療.月刊糖尿病 2015/1 Vol.7 No.1
医原性プラーク停滞ファクター
歯周病成り立ちの第一ステップであるポケット内へのプラーク停滞の原因は、ブラッシングの不良だけではない。本人の努力の及ばないところに原因があったりする。
たとえば不適合補綴物。補綴物のマージンが支台歯の本来の位置より外側にあるタイプの不適合を「オーバーハング」という。冠表面の”盛り上げすぎ”のことで、下から上へスケーラーを引き上げても、この外側に飛びだしたオーバーハング部分がステップを作り、スケーラーのストロークを邪魔してプラークを除去できない。
また、補綴物マージンが歯肉縁下(しにくえんか)深くに設定されてもプラーク停滞の原因になる。マージンが歯肉縁下に設定されるとは、かぶせ物の辺縁が歯茎のトップより根尖側に入っている状態のことだ。被せものと歯面、あるいはインプラントのアバットメントとの境界部は不潔域であり、歯周病学的には、この部は歯肉縁より上のレベルに位置することが望ましい。なぜ、歯肉縁下ではプラークがたまるのか?それ境界部が歯肉に隠れて見えないから、プラークが残っていても気づかず、したがって磨き残すからだ。また、境界部は完全なフラットなサーフェイスになりようがなく、どうしても微小な隙間が空く。通常この隙間は補綴物装着用セメントで充填されるが、このセメントがまたザラザラしているゆえに格好のプラークの付着部位となる。よって、補綴物マージンを歯肉縁下に設定した場合は、どうしてもマージン部がプラ―ク停滞を招く。Schätzle らの報告によると、スカンジナビア男性の26年間のコホート研究では、歯肉縁下に補綴マージンを設定したグループでは、10年後に0.5mmのアタッチメントロスを起こしていたという(1)。ペリオの管理面から言うと、補綴物マージンを歯肉縁上に設定した方が、圧倒的に、歯周病の予防をしやすいのだ。
だから、あまり歯肉縁下深い補綴マージン設定は、医原性プラーク停滞ファクターと言っていいかも知れない。
参考文献
歯周ポケットからの炎症の波及と骨吸収の関係
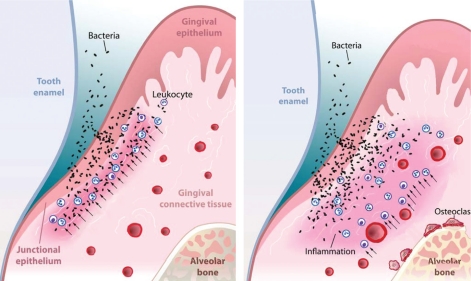
歯周炎においては、細菌は歯周ポケット内部の根面に付着するだけでなく、ポケットを構成する内縁上皮の表面から内部の結合組織に向かって侵入することは以前書いた。この細菌が侵入したゾーンには、好中球と単球(マクロファージ)も浸潤してくる。つまり、そこはバトルフィールドだ。このバトルフィールドを病理学的に表現すれば炎症性細胞浸潤だ。この好中球や単球(マクロファージ)は、細菌を捕獲し、貪食する為に、血管から抜け出してやって来る。この場合、好中球や単球(マクロファージ)は、非特異的に細菌を攻撃している。無差別だ。
ところで侵入しようとする細菌と、それを阻止しようとする好中球や単球の防衛ラインが歯肉表面近くにとどまっている場合、これを歯肉炎という。骨からまだ遠いゾーンでのバトルなので、まだ骨吸収は起こらない。ところが、この防衛ラインが深部に後退すると、前線が骨に近づいてくる。こうなると炎症が起っているゾーンに必ず顔を出す免疫担当細胞が、破骨細胞系の活性化のスイッチを入れるサイトカインを放出し始めるので、破骨細胞が活性化され、骨吸収が起る。これが歯周炎だ。骨吸収までいってしまったら歯周炎なのだ。だから、バトルフィールドを後退させず、それを歯肉表面近くで死守できれば、より重度の歯周炎への進行をブロックできる。
参考文献(1):Graves DT,Oates T,Garlet GP. Review of osteoimmunology and the host in endodontic and periodontal lesions. J Oral Microbiol 2011,3:5304-DOI:10.3402/jom.v3iO.5304.
炎症性サイトカイン
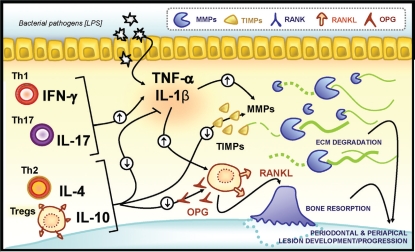
歯周病の進行を分子的レベルで見ていきたい。そこで、今日のテーマはサイトカインだ。サイトカインとは、免疫システムの細胞から分泌される一連のタンパク質群で、特に標的を特定しない情報伝達を介在するものをいう。実に多くの種類のサイトカインが存在し、その多くは免疫や炎症に関係した働きをしている。歯周病を分子的に見るときに、このサイトカインと呼ばれる一連のタンパク質群がとても重要な役割をしているのだ。
歯周病菌から放出されるLPSや絨毛が、炎症のイニシャルトリガーとして働き、マクロファージ表面に存在するTLR(Toll-like Receptor)といわれるレセプターを刺激し、マクロファージに前炎症サイトカインと呼ばれるTNF-αやIL-1βを産生させる。このTNF-αやIL-1βが、線維芽細胞に働きかけ、MMP(マトリックスメタロプロテアーゼ)を産生させる。MMPは細胞外マトリックスを破壊する酵素だ。このMMPにより歯周組織の付着の喪失=アタッチメントロスが引き起こされる。また、MMPは、好中球、B細胞、形質細胞からも産生される。
また、TNF-αのようなサイトカインは、破骨細胞も刺激する。その一方で、IL-1B,IL-6のようなサイトカインは骨芽細胞を刺激してRANKLを発現させることで、やはり破骨細胞を刺激し骨吸収を促進している。
その一方、Th2やTregsと呼ばれる細胞(T regulatory cells)は、IL-4(インターロイキン-フォー)やIL-10(インターロイキン-テン)、TGF-βといったサイトカインを放出して、これらの作用により、骨吸収を抑制している。
このように、サイトカインは、骨吸収というイベントにおいて、ポジティブな作用とネガティブな作用の両方に関与している。どうです、サイトカインの話はややこしいでしょう。
歯周病はこの様に、サイトカインの結構、ややこしい働きの結果、その病態が作られるのだ。
図は文献(1)より引用.
参考文献(1):Graves DT,Oates T,Garlet GP. Review of osteoimmunology and the host response in endodontic and periodontal lesions. J Oral Microbiol 2011,3:5304-DOI:10.3402/jom.v3iO.5304.
歯周病の骨吸収はどのように起こるか?ーそのメカニズムー
歯周病の進行は4つのステージからなる。第一ステップは歯周病菌が歯周ポケットに停滞する段階。第二ステップは歯周病菌が粘膜上皮内、そしてその下方の結合組織内に侵入する段階。第三ステップはこの細菌の刺激により、ホスト(宿主)の応答のスイッチが入る段階。このホストの応答は、免疫応答の活性化を含んでいる。第4ステップは結合組織と骨の破壊だ。この4つのステージはいずれも炎症という共通項でくくられるのだが、この一連の炎症反応のクライマックスとして骨吸収が起こり、アタッチメントロスが生じて歯の動揺が起るわけだ。今日のテーマは、この最終局面の骨吸収はどのように起こるのか?というテーマで、そのメカニズムについて言及したい。
骨吸収は破骨細胞が働くことで起こる。破骨細胞の働きは、文字通り、骨を破壊することだ。骨を食べるのだ。この破骨細胞は、実は免疫系によりコントロールされている。
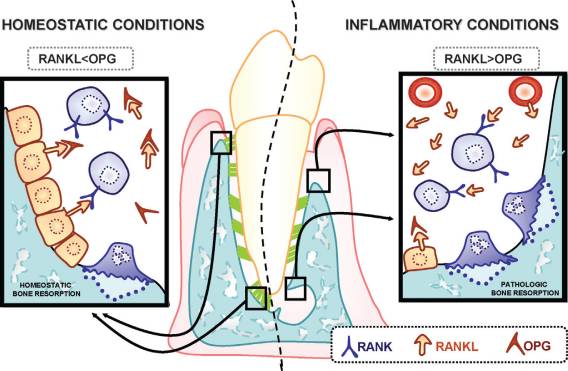
具体的に言うとこうだ。B-cell,T-cell,単球は免疫を担当す細胞群だが、こういった免疫担当細胞はRANKL(ランクル)というリガンド(特定の受容体に特異的に結合する物質)を産生する。(RANKLの正式名称は、receptor activator of nuclear factor kappa-B ligandというのだが、何度読んでも覚えられないので以後割愛。一般には”ランクル”の方が通りが良い。)このRANKLの受容体(RANK)は破骨細胞表面に存在して、RANKLがRANKに結合すると、その指令が破骨細胞を活性化させ、骨吸収を開始する。興味深いのは、骨代謝の現場では、RANKLを産生している細胞は、骨を形成する骨芽細胞やその前駆細胞である点だ。第二ステップで炎症のシグナルスイッチが入ると、歯周病菌によって刺激を受けたマクロファージがIL-1(インターロイキン-ワン),IL-6(インターロイキン-シックス)といったサイトカインを放出する。すると、そのサイトカインを認識した骨芽細胞がRANKLを生成し、それを破骨細部の前駆細胞(単球/マクロファージ系)がRANK(ランク)と呼ばれる受容体でキャッチし、破骨細胞へと分化する。つまり、骨芽細胞が破骨細胞の前駆細胞を刺激して、それを破骨細胞へと変貌させるわけだ。そして骨吸収が開始される。
このように、骨芽細胞が破骨細胞を刺激して骨吸収を活性化させるわけだが、一方で、骨芽細胞は別の方法で破骨細胞の活動を押さえ、骨吸収を抑制しているという事実がある。骨芽細胞が破骨細胞を働かせたり、休ませたりしているわけだ。その、破骨細胞を抑え込むのは、オステオプロテゲリン(osteoprotegerin) という破骨細胞抑制因子の作用だ。オステオプロテゲリンとは、RANKと競合する受容体で、破骨細胞表面のRANKがRANKLと結合する前に、RANKLを横取りして自身と結合することで、破骨細胞の活性化を抑制するのだ。このオステオプロテゲリンは、骨芽細胞、線維芽細胞、肝細胞など、多様な細胞から産生され、破骨細胞分化抑制因子として作用する。
このように骨芽細胞の放つRANKLとオステオプロテゲリンとは相反する作用をしている。RANKLは骨吸収を促進する作用を、そしてオステオプロテゲリンは骨吸収を抑制する作用をする。このような相反する効果を及ぼす物質を、同じ骨芽細胞が放つところは興味深い。これは骨代謝のバランスをコントロールするよく出来たシステムだ。つまり、オステオプロテゲリンの効果が優勢である時は骨吸収はそこそこに抑えられ、その程度が骨形成の程度とバランスがとれているなら骨量は一定に保たれる。しかし、RANKLの効果がオステオプロテゲリンの効果を上回るとき、骨吸収の程度は骨形成の程度をはるかに上回り、骨吸収が顕著に発現する。
図は文献(1)より引用.
参考文献(1):Graves DT,Oates T,Garlet GP. Review of osteoimmunology and the host response in endodontic and periodontal lesions. J Oral Microbiol 2011,3:5304-DOI:10.3402/jom.v3iO.5304.
歯周炎の進行度や表現型に個人差が出るのはなぜか?
歯周病が歯周病菌の感染によりスタートすることは,疑いようがないほど決定的だが、歯周病菌が感染して以降、どのような経過をとるかは、個人差がある。つまり、歯周病の表現型には多様性があり、細菌だけではその多様性は20%程度しか説明できない、と言われている。では、その多様性には何がからんでいるのか?今日はそれがテーマだ。
その多様性を説明するキーワードが「リスクファクター」なのだ。歯周炎の実像は単純ではない。歯周炎の進行は、細菌が歯周ポケットに感染すると、これが”カスケードと呼ばれる炎症の連鎖反応のスイッチを入れたことになり、後はドミノ倒し的に抗原に対する宿主応答が自動的、連鎖反応的に起り、最終的に結合織や骨の破壊にいたる、といった単純な一方通行のモデルではない。細菌の感染がスイッチで、骨や結合織の破壊といった決定的なイベントが終末反応とするなら、スイッチが入ってから終末反応にいたるまでに、いわゆる「リスクファクター」が、そのカスケードの進行に影響を及ぼし、歯周炎の進行に変調を起こさせる。
ところで「リスクファクター」には改変不可能なものと、改変可能なものがある。前者の具体的なものとして、年齢、骨祖鬆症、全身疾患、過去の歯周病歴が挙げられ、後者の具体的なものとして、全身疾患に対して投与する内服薬、ホルモン変化、心理社会的ストレス(慢性ストレスやうつ病)、不正咬合、早期接触、パラファンクションなどが挙げられる。
こういったリスクファクターのうちのどのファクターが大きく関与するかで、歯周炎の進行度や表現型に個人差が出るわけだ。
参考文献:築山鉄平/宮本貴成.歯科医療のイノベーションを考えるー歯周病の観点からーthe Quintessence.Vol.35.No.9.44-64.2016.
よく咬める咬合面形態について(1)
よく咬める歯の形、特に咬合面の形態ってどんなのをいうんだ?その前によく咬める状態と、あまり咬めない状態を、どうやって評価するのだ?患者さんからの申告だけでなく、客観的な方法とは?
チェアサイドでの咀嚼効率を測定する方法の一つに、グミゼリーを咀嚼試料として、グミゼリーから溶出するグルコース量を、簡易型血糖測定器で計測する方法が考案され、現在では咀嚼能力測定グルコラム/グルコセンサーGS-Ⅱ(ジーシー社製)として発売されている。咀嚼効率を客観的に評価することで、第一大臼歯咬合面形態を機能的に評価することが可能となる。第一大臼歯の咬合面形態がよく咬める形態になっていると、グルコースがじわーっとよく溶けだすというわけだ。
こういった方法で客観的に咀嚼効率を評価すると、”咬める歯”の条件を明らかにすることができる。その中の一つに咀嚼運動経路がある。咀嚼運動経路とは、下顎の代表点の3次元的な運動の軌跡を、前頭面(頭蓋骨を正面から見た面)や矢状面(側方から見た面)に投影したものだ。前頭面から見た咀嚼運動経路は、健常者では、一つのパターンとして、たとえば右側で咬む場合、往路と復路は異なっている。つまり、開口路として下顎はやや右側にずれながら下方に下がり、最下方に達したら、閉口路はそこからやや右側に膨らんだ軌跡で中央の開口前のスタート位置にもどる。健常者のもうひとつのパターンとして、開口路として、下顎は正中からいったん、咬む側と反対側の左側の方に振られ、ある程度口があいてきたら、そこから右側に向かい始め、最下方に達したら、さらに右側に膨らんだ軌跡で開口前のスタート位置にもどる。後者は前者よりも、水平のベクトル量が多い。つまり、前者は垂直に近い状態で斜め下方に口を開けているのに対して、後者は水平の遊びの動きを含みながら斜め下方に口を開けている、という違いがある。そして、咀嚼効率は垂直性の運動要素が強い前者の方が高い。
こういった咀嚼運動経路は何がその決定要素になるかというと、それが大臼歯の咬合面形態だ。機能的な咬合面形態が出来ていると、上下顎の機能咬頭内斜面によって形成される圧縮空間から主機能部位への経路がスムーズになるため閉口路の速度も速くなり、咀嚼力が第一大臼歯に効率よく伝達され、食物の圧搾と粉砕の効率が上がると考えられている(1).
文章だけで三次元的な運動路の話をするのはわかりにくいかも知れないが、咬む面の形態によって咀嚼効率が変わることをいいたかった。
参考文献(1):なぜ、補綴治療が第一大臼歯の保存に役立つのか?the Quintessence. Vol.35.No.12. 125-135.2016.