歯周病の進行は4つのステージからなる。第一ステップは歯周病菌が歯周ポケットに停滞する段階。第二ステップは歯周病菌が粘膜上皮内、そしてその下方の結合組織内に侵入する段階。第三ステップはこの細菌の刺激により、ホスト(宿主)の応答のスイッチが入る段階。このホストの応答は、免疫応答の活性化を含んでいる。第4ステップは結合組織と骨の破壊だ。この4つのステージはいずれも炎症という共通項でくくられるのだが、この一連の炎症反応のクライマックスとして骨吸収が起こり、アタッチメントロスが生じて歯の動揺が起るわけだ。今日のテーマは、この最終局面の骨吸収はどのように起こるのか?というテーマで、そのメカニズムについて言及したい。
骨吸収は破骨細胞が働くことで起こる。破骨細胞の働きは、文字通り、骨を破壊することだ。骨を食べるのだ。この破骨細胞は、実は免疫系によりコントロールされている。
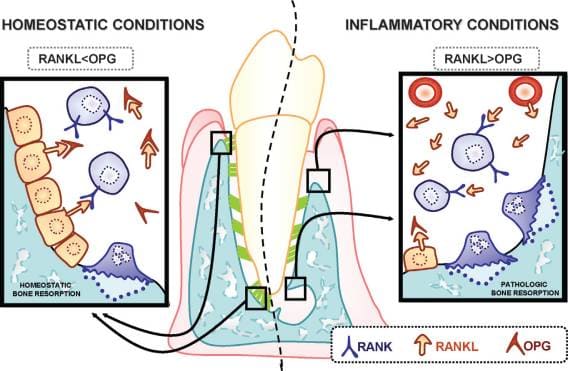
具体的に言うとこうだ。B-cell,T-cell,単球は免疫を担当す細胞群だが、こういった免疫担当細胞はRANKL(ランクル)というリガンド(特定の受容体に特異的に結合する物質)を産生する。(RANKLの正式名称は、receptor activator of nuclear factor kappa-B ligandというのだが、何度読んでも覚えられないので以後割愛。一般には”ランクル”の方が通りが良い。)このRANKLの受容体(RANK)は破骨細胞表面に存在して、RANKLがRANKに結合すると、その指令が破骨細胞を活性化させ、骨吸収を開始する。興味深いのは、骨代謝の現場では、RANKLを産生している細胞は、骨を形成する骨芽細胞やその前駆細胞である点だ。第二ステップで炎症のシグナルスイッチが入ると、歯周病菌によって刺激を受けたマクロファージがIL-1(インターロイキン-ワン),IL-6(インターロイキン-シックス)といったサイトカインを放出する。すると、そのサイトカインを認識した骨芽細胞がRANKLを生成し、それを破骨細部の前駆細胞(単球/マクロファージ系)がRANK(ランク)と呼ばれる受容体でキャッチし、破骨細胞へと分化する。つまり、骨芽細胞が破骨細胞の前駆細胞を刺激して、それを破骨細胞へと変貌させるわけだ。そして骨吸収が開始される。
このように、骨芽細胞が破骨細胞を刺激して骨吸収を活性化させるわけだが、一方で、骨芽細胞は別の方法で破骨細胞の活動を押さえ、骨吸収を抑制しているという事実がある。骨芽細胞が破骨細胞を働かせたり、休ませたりしているわけだ。その、破骨細胞を抑え込むのは、オステオプロテゲリン(osteoprotegerin) という破骨細胞抑制因子の作用だ。オステオプロテゲリンとは、RANKと競合する受容体で、破骨細胞表面のRANKがRANKLと結合する前に、RANKLを横取りして自身と結合することで、破骨細胞の活性化を抑制するのだ。このオステオプロテゲリンは、骨芽細胞、線維芽細胞、肝細胞など、多様な細胞から産生され、破骨細胞分化抑制因子として作用する。
このように骨芽細胞の放つRANKLとオステオプロテゲリンとは相反する作用をしている。RANKLは骨吸収を促進する作用を、そしてオステオプロテゲリンは骨吸収を抑制する作用をする。このような相反する効果を及ぼす物質を、同じ骨芽細胞が放つところは興味深い。これは骨代謝のバランスをコントロールするよく出来たシステムだ。つまり、オステオプロテゲリンの効果が優勢である時は骨吸収はそこそこに抑えられ、その程度が骨形成の程度とバランスがとれているなら骨量は一定に保たれる。しかし、RANKLの効果がオステオプロテゲリンの効果を上回るとき、骨吸収の程度は骨形成の程度をはるかに上回り、骨吸収が顕著に発現する。
図は文献(1)より引用.
参考文献(1):Graves DT,Oates T,Garlet GP. Review of osteoimmunology and the host response in endodontic and periodontal lesions. J Oral Microbiol 2011,3:5304-DOI:10.3402/jom.v3iO.5304.