フリーラジカルと活性酸素は同じような意味合いで解釈されやすいですが、本来、定義上、両者は全く別物です。よって、ここで両者の定義を明らかにしておきます。
フリーラジカルは、「対をなさない電子(不対電子)を持つ原子や分子」と定義されます。不対電子はペアになりたがるので、フリーラジカルは一般には不安定で、反応性が高い状態です。ここのところを少し説明すると、電子は電子殻の中を周回しているのですが(電子殻は内側から外側に向かって、K殻・L殻・M殻・N殻・・・と順番に名前が決められ、電子は必ずK殻から入って行きます。)、さらに、それぞれ一番外側の電子殻には、電子が2個ずつ入る「小軌道」があって、各小軌道での電子収容数の和がその電子殻での収容数となるのですが、その小軌道に電子が2個揃うと安定する性質があります。そして1個しかない場合は不安定な状態で、この状態がフリーラジカルです。そして、前述したように不対電子はもう一個の電子を求めてペアを作りたがります。その電子を手に入れる方法が他の物質と反応することなのです。
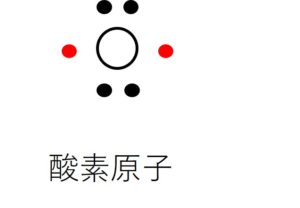
たとえば、酸素を例にとって説明します。酸素は周期律では第Ⅵ族に属し、原子番号は8です。したがって電子の数も8個持っています。電子軌道の内側のK殻に2個、外側のL殻に6個の電子がぐるぐる超高速で回っています。この酸素を電子式で表すと、電子式は最外殻の電子をドット(・)表記する約束になっているので、酸素の電子式は図のように表現されます。外側の6個の電子のうち4個(黒丸)は電子対をなしていますが(2個の電子が対をなした状態を電子対といいます)、残りの2個(赤丸)は1個づつの対をなさない電子(不対電子とよびます)です。したがって酸素原子や酸素分子はフリーラジカルです。酸素が多くの物質と反応しやすいのはフリーラジカルだからです。
酸素と多くの物質との反応は酸化反応とよばれ、最も身近な化学反応です。たとえば、紙や木が燃えるのは炭化水素が酸素と反応し、二酸化炭素と水へと変化する酸化反応です。発生するエネルギーが大量なので、燃焼という形で発光と発熱を伴います。
金属が錆びるのは、金属が酸素と結びついて酸化物を生成する酸化反応です。錆は鉄が酸化して生成した酸化鉄(III)(赤褐色)で、銅が酸化すると、赤褐色の酸化銅(I)や黒色の酸化銅(II)になります。
食物を室温で放置すると徐々に色や味が変わってくるのも、酸化が原因です。このため、食品には種々の酸化防止剤が用いられることになります。
また、摂取した食物が体内でエネルギーに変わるのも酸化反応であり、この酸化反応のために必要な酸素を体内に取り込み、生成物である二酸化炭素を放出しています。
このように酸素はきわめて反応性が高いユニークな物質ですが、フリーラジカルゆえの性状といえます。
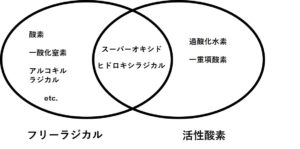
一方、活性酸素とは、以前説明したように、酸素分子が電子を受け取ることでエネルギーが付与され励起された状態となり、「酸素よりも反応性の高まった分子のグループ」と定義されます。本来、「フリーラジカル」と「活性酸素」とは定義上、別物ですが、実際には活性酸素の一部のものはフリーラジカルであり、フリーラジカルの一部のものは活性酸素です。つまり、活性酸素には4種(スーパーオキシド、ヒドロキシルラジカル、過酸化水素、一重項酸素)がありますが、このうち、「スーパーオキシド」と「ヒドロキシラジカル」の2つはフリーラジカルです。ちょっとややこしいですが、図示するとわかりやすいです。
(次回へ続く)